君实生物抗PD-1单抗III期临床达到主要终点,将提交上市申请
竞争激烈的定制家居赛道,我乐家居何以逆势上涨
中国创新药加速上市的“奥秘”,金秋10月的这场大会将重磅揭晓
晶瑞股份斥资7500万元进口韩国ASML光刻机设备
北美观察丨直击大选:特朗普被曝“避税达人”,拜登借机拉拢摇摆选民
约28万美国学龄儿童感染新冠病毒
泰勒之死宣判令全美怒火再燃 处罚美国警察暴力执法为何这么难?
【全面建成小康社会“百城千县万村调研行”】从单一到多元 留车村的两次产业升级
全美20多个州新冠疫情呈现反弹势头 专家:秋冬防疫异常艰难
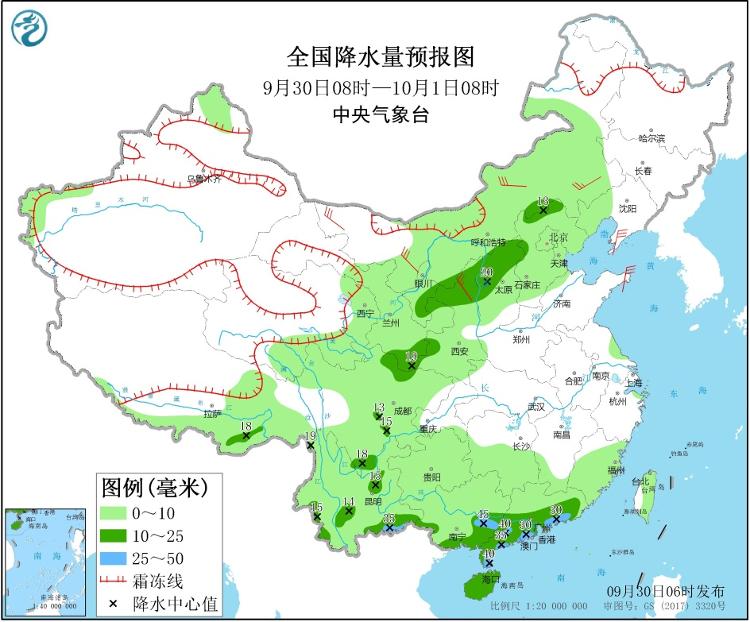
西北地区东部华北东北地区等地降雨降温 西南地区东部江汉等地将有大到暴雨
青藏高原唯一一所全日制农牧类高职院校迎来建校80周年
【图说】接地气!6句话看中国交通扶贫成效
抗击新冠肺炎疫情全国三八红旗手(集体)表彰云发布活动在北京举行
两部委发布首个马产业发展规划 探索推广赛马运动
国家粮食和物资储备局局长张务锋:各地已建立389个粮油示范县
外交部:美国才是南海军事化的最大推手!
电商主播薇娅被授予抗疫全国三八红旗手称号
违法问题屡禁不止 生态环保督察再戳央企下属企业痛点
节前密集通报违反八项规定精神问题 释违纪必纠信号
谋划新格局 开拓新机遇——访中国社会科学院副院长蔡昉
辽宁省本溪市人民检察院检察长王红日被“双开”
广东副省长张新:希望海内外朋友继续参与广东发展
外交部就蓬佩奥扬言构建反华全球网络、中印边境局势等答问
一千台!中国盾构机从零到世界第一
一批标志性金融项目落户北京城市副中心
新业态新职业“喊渴” 职校人才培养跟不上市场需求
中新社国是论坛之“能源中国”召开 聚焦汽车电动化
关键核心技术必须揣在自己兜里
《为抗战吹响号角》主题展在沈阳“九·一八”历史博物馆开幕
文化传承需用好传统节日载体
四川珙县多名教师反映合理申请跨县调动被拒 官方回应
半边天空的隐秘心事:全世界范围内月经贫困普遍存在
中国政府抗疫医疗专家组抵达非洲 开展经验分享
“双非校”名额难求 推免生是否抢了考研生“奶酪”
后疫情时代全球治理走向何方?——来自外交部蓝厅论坛的声音
中国对澳大利亚进行渗透和间谍活动?外交部:从来不会也没有必要
多国专家学者认为新疆经济社会发展和民生改善取得巨大成就
云南迪庆州:吃上旅游饭 风景变“钱景”
国庆能不能安心出游?秋冬疫情怎么防?权威解答来了!
政协委员建言献策 推进福建宁德中小微企业持续健康发展
世界口径最大全可动低频射电望远镜项目在云南景东启动
西藏三大民生工程进展顺利 预计2021年全部建成投用
【西部开发新脉动】苍山下 洱海边 大理这碗“生态饭”端稳了!
【地评线】荔枝网评:“入富”尽显中国市场“磁石”魅力
中阿卫生专家视频会议29日举行 宁夏向多国分享抗疫经验
国家卫健委:已连续44天无新增本土确诊病例报告
山东德州62名干部召回管理 集中再教育再锻炼再考核
山东破解“职校只招收低分生”难题学生就业率达九成
中疾控专家:全球疫情未来一段时间得到很好控制的可能性不大
让我们每个人都成为“双节”最美的风景
亿欧大健康9月29日获悉,近日君实生物特瑞普利单抗注射液(PD-1抑制剂,商品名:拓益)联合化疗治疗复发性或转移性鼻咽癌的随机、双盲、安慰剂对照、国际多中心的III期临床研究(以下简称:“JUPITER-02研究”)在期中分析中,由独立数据监察委员会判定达到了预设的主要研究终点。
JUPITER-02研究结果表明,特瑞普利单抗注射液联合吉西他滨/顺铂一线治疗复发性或转移性鼻咽癌患者,较吉西他滨/顺铂的标准一线治疗,可显著延长患者的无进展生存期。君实生物将于近期向国家药监局及相关国家药监部门递交上市申请。
值得注意的是,今年以来特瑞普利单抗注射液取得了不少注册进展。今年5月特瑞普利单抗治疗鼻咽癌获得FDA孤儿药认定;到了9月,其用于鼻咽癌的治疗获得美国食品药品监督管理局(FDA)突破性疗法认定。这也意味着,它成为首个获得FDA突破性疗法认定的国产抗PD-1单抗。
特瑞普利单抗注射液作为中国首个批准上市的以PD-1为靶点的国产单抗药物。自2016年初开始临床研发,它至今已在中、美等多国开展了覆盖十余个瘤种的30多项临床研究。
目前特瑞普利单抗注射液在国内批准上市及已获受理的适应症情况如下:
2018年12月,特瑞普利单抗注射液获得国家药监局有条件批准上市,用于治疗既往标准治疗失败后的局部进展或转移性黑色素瘤;
2020年4月,特瑞普利单抗注射液用于治疗既往接受过二线及以上系统治疗失败的复发/转移鼻咽癌的新适应症上市申请获得国家药监局受理,该适应症的上市申请是全球首个抗PD-1单抗治疗复发/转移鼻咽癌的新药上市申请;
2020年5月,特瑞普利单抗注射液用于治疗既往接受过系统治疗的局部进展或转移性尿路上皮癌的新适应症上市申请获得国家药监局受理。
相关推荐
猜您喜欢
- 中方谈全球如何共同面对生物多样性丧失的严峻挑战
- 中国将发布实施生物样本库认可等5项新认可制度
- 强生新冠疫苗进入III期临床试验,大选前疫苗出炉有望吗?
- 纵横胶原市场二十载,创尔生物如何掘金千亿“颜值经济”?
- 古生物学家发现1亿年前的动物精子
- 三部门联合发文鼓励生物质发电项目市场化运营
- 2020年细胞和基因疗法领域:值得关注的5家新兴生物制药公司
- 从天山生物被二次核查 看市场化监管的AB面协同
- 中科院启动“衰老的生物学基础和干预策略”战略先导专项
- 拦不住的妖股!天山生物斩获12天11板丨牛熊眼
- 国产新冠疫苗“服贸会”首次亮相!已开展Ⅲ期临床试验
- 高瓴牵头砸进4亿美金,加持天境生物联手艾伯维开发明星靶点CD47
- “妖股”天山生物复牌再涨停 “8连板”背后的推手是谁?
- 科创板迎来首家纯化药企业,苑东生物开盘涨超70%
- 我市高端生物基产业发展规划论证评审会召开