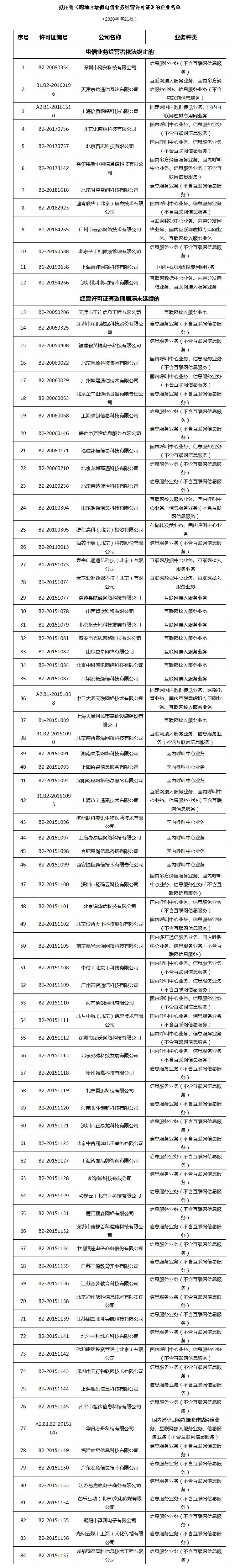
中国发布《生物制品批签发管理办法》 规范疫苗批签发管理
中疾控专家:不推荐孕妇接种新冠疫苗
推动能源绿色低碳转型——聚焦《新时代的中国能源发展》白皮书
政协委员解读:中国反垄断进入“强监管”时代
专家称中国亟需加强公共卫生体系战略性研究
“亚洲水塔”冰川湖泊河流水量:超过9万亿立方米
中疾控专家:不建议新冠疫苗与HPV疫苗同时接种
吴尊友:消费者采购食用进口冷链食品引起感染新冠的风险非常低
别只惦记火箭上天 残骸回收也有大讲究
报告:有声内容已成为全球出版传媒业的共同增量
“中国确定性”让世界更踏实
接种新冠疫苗后,还用勤洗手、戴口罩吗?吴尊友的答案来了
综合消息:多国发布与英国之间的航班禁令
百万人次紧急接种表明我国新冠疫苗安全
中国驻加使馆驳加领导人错误言论 敦促加方严肃对待中方立场
新舟700飞机首飞前最后一项全机工况试验完成
“一带一路”制造“债务陷阱”?中方回应
香港终审法院就《紧急情况规例条例》和《禁止蒙面规例》裁定特区政府胜诉
中国向柬埔寨捐赠20万支动物疫苗
轨道测量“大师”助力火箭发射 创造“中国精度”
中方:坚决反对外部势力在白俄罗斯社会制造分裂和动荡
全国高校“数字马院”联盟年会在北京举行
新疆宗教人士答清真寺安装摄像头:是为保护我们和信教群众的安全
从无到有!探秘嫦娥五号背后的故事
王毅就伊朗核问题提出四点主张
宁夏慈善总会第四届理事会募集善款善物3.29亿元
西藏大力推进农牧民转移就业——学会新技能 迈向新生活
山西出台办法规范政务数据管理与应用
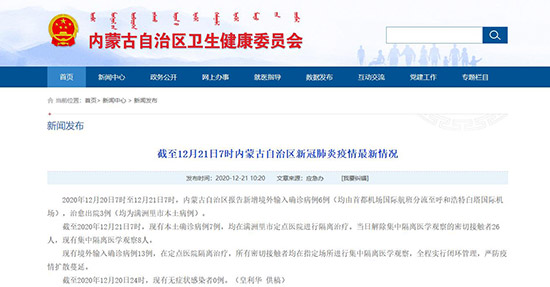
国家卫健委:对新增散发病例或聚集性疫情要发现一起扑灭一起
中国如何平衡能源安全保障与清洁低碳转型?回应来了
大洋网评:完善收入分配制度 推动构建完整内需体系
国务院新闻办发布《新时代的中国能源发展》白皮书
专家称中国新冠疫苗非常安全 接种者未现严重不良反应
完成月球之旅,冰墩墩雪容融回家啦!
武汉铁路公安局原副局长童光明接受审查调查
特朗普签“外国公司问责法案” 外交部:敦促美方不得实施该法中的涉华歧视性条款
白皮书:2019年中国碳排放强度较2005年下降48.1%
禁令之下,二手平台上为何还能买到开房记录、户籍等个人信息?
吴尊友:采购食用进口冷链食品感染新冠风险非常低
特朗普将“外国公司问责法案”签署成法 中方回应
报告称“十四五”期间中国劳动年龄人口仍保持在9亿人左右
中国参与对美国政府机构网络攻击?外交部回应
中国记协发布《中国新闻事业发展报告》
北向资金今日净流入78.61亿元,加仓隆基股份超7.5亿元
严惩监管“内鬼”,今年10多名金融监管干部被查
永煤事件逐一问责,海通证券相关负责人遭处罚
储运加工环节年损粮食700亿斤 粮食安全保障法将专门立规堵漏
美俄再打外交战?特朗普政府将关闭美驻俄两领馆
英国新病毒株引发欧洲恐慌 但尚无证据表明疫苗失效
石家庄市长邓沛然落马,曾在纪检部门工作多年,出版反腐专著
中新社北京12月21日电 (记者 王庆凯)中国国家市场监管总局21日消息,《生物制品批签发管理办法》(以下称《办法》)近日被审议通过,将自2021年3月1日起实施。
疫苗关系民众健康,关系公共卫生安全和国家安全。国家市场监管总局表示,《办法》修订过程中,细化了《中华人民共和国疫苗管理法》《中华人民共和国药品管理法》确定的原则制度,借鉴国外有关批签发管理的先进经验,进一步完善生物制品批签发机构确定、批签发申请与审核检验等管理举措。同时,严格审批管理,进一步夯实药品上市许可持有人主体责任,强化生物制品批签发的监督管理。
《办法》规定省级药品监管部门负责本行政区域内批签发机构的日常管理,对企业生产过程中出现的可能影响产品质量的重大偏差进行调查。
《办法》规范了批签发管理要求,明确批签发豁免情形、检验项目和频次要求,强化生产工艺偏差管理。对疫苗产品和其他生物制品批签发方式、检验项目和频次分别作出细化规定,要求疫苗批签发应当逐批进行资料审核和抽样检验。
《办法》要求,落实上市许可持有人主体责任,强化全生命周期管理要求。增加规定药品上市许可持有人应当建立完整的生产质量管理体系,持续加强偏差管理;批签发产品应当按照经核准的工艺生产,并应当符合国家药品标准和药品注册标准。明确对存在质量问题或者其他安全隐患的产品,持有人应当采取停止销售、使用,召回缺陷产品等措施。(完) 【编辑:丁宝秀】
相关推荐
猜您喜欢
- 中疾控专家:不推荐孕妇接种新冠疫苗
- 推动能源绿色低碳转型——聚焦《新时代的中国能源发展》白皮书
- 政协委员解读:中国反垄断进入“强监管”时代
- 专家称中国亟需加强公共卫生体系战略性研究
- 中疾控专家:不建议新冠疫苗与HPV疫苗同时接种
- “中国确定性”让世界更踏实
- 接种新冠疫苗后,还用勤洗手、戴口罩吗?吴尊友的答案来了
- 百万人次紧急接种表明我国新冠疫苗安全
- 中国向柬埔寨捐赠20万支动物疫苗
- 轨道测量“大师”助力火箭发射 创造“中国精度”
- 中国如何平衡能源安全保障与清洁低碳转型?回应来了
- 专家称中国新冠疫苗非常安全 接种者未现严重不良反应
- 报告称“十四五”期间中国劳动年龄人口仍保持在9亿人左右
- 中国参与对美国政府机构网络攻击?外交部回应
- 中国记协发布《中国新闻事业发展报告》