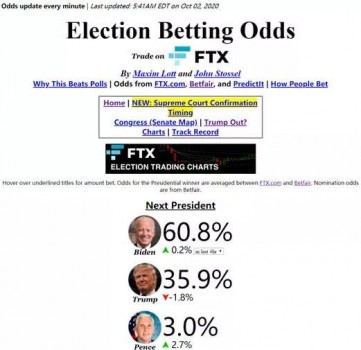
美国总统特朗普曾向民众承诺“十月惊喜”,即政府最快将在10月大规模分发疫苗。不过美国食品药品管理局(FDA)当地时间10月6日明确表示,在批准任何疫苗之前,他们需要看到志愿者接种第二剂新冠疫苗后两个月的随访数据。
第一财经记者了解到,美国首个大规模新冠疫苗临床试验于今年7月底才启动,第二剂接种时间为第一剂之后的21天或28天,以此推算,10月底前任何疫苗厂商都很难获得FDA的批准,特朗普的“期盼”很可能会落空。

根据FDA最新发布的一份针对疫苗厂商的指南,来自三期临床研究的数据应包括完成完整的疫苗接种方案后至少两个月的中位随访时间,以提供足够的信息来评估疫苗的受益风险概况,这些数据包括不良事件、研究对象的新冠重症病例,以及在疫苗的适应性(而非先天性)和记忆性免疫反应起到保护作用的时间内所发生的新冠病例。
美国FDA批准疫苗的生物制剂评估和研究中心主任彼得·马克斯(Peter Marks)博士在接受医学期刊《JAMA》杂志采访表示:“随访两个月的做法是正常的,我们必须平衡在安全性和迫切性当中做出平衡。”
目前在美国临床试验中进程最快的疫苗是Moderna以及辉瑞公司生产的新冠疫苗,都需要两剂接种。测试疫苗的研究人员正在等待观察多少人在接种疫苗后仍感染了新冠病毒,以及与注射安慰剂的人相比,接种了真正疫苗的人的感染数量是否更少。
研究人员最担心的是疫苗的安全性。马克斯博士说道:“如果我们获得一种具有70%或80%功效的疫苗,并且向70%或80%的人口进行接种,这才有可能形成群体免疫。所以提升人们对疫苗的信心非常重要。”
美国FDA官员明确表示,他们希望与疫苗生产商进行对话,而不仅仅是制定必须遵循的严格规则。为此,美国FDA还将召开疫苗和相关生物制品咨询委员会的公开会议。美国国立卫生研究院主任柯林斯(Francis Collins)在约翰·霍普金斯大学和华盛顿大学主办的一场疫苗研讨会上表示:“咨询委员会将会做出建议,FDA将决定是否接受这些建议。”
一位疫苗专家对第一财经记者表示,对于疫苗的大多数不良反应,通常会发生在人们接种了疫苗后的两至三个月之间,“美国FDA做出要求对疫苗接种后随访2个月的决定,是正确的。”
值得一提的是,当地时间10月6日,世卫组织总干事谭德塞首次就新冠疫苗推出时间表态说:“新冠疫苗可能在今年年底前准备推出。我们需要疫苗,希望到今年年底人们能够接种疫苗。”
相关推荐
猜您喜欢
- 美国国会公布反垄断调查报告,认定苹果、谷歌等四大科技公司滥用市场主导地位
- 女子被假冒美国大兵骗83万 警方辗转5千公里破案
- 美媒:“非常令人担忧”的就业报告表明 美国经济复苏可能正在放缓
- 美国企业债突遭大幅抛售,垃圾债市场还值得投资吗?
- 世界周刊丨粗鲁、混乱……这场“史上最糟糕”辩论,又见美国的撕裂
- 中芯国际:部分供应商受美国出口管制规定的进一步限制
- 美国9月新增就业不及预期 裁员大幅增长
- 中国常驻联合国代表团发言人就美国国务卿及美国教育部长有关涉华言论发表谈话
- 国外罕见提前公布新冠疫苗试验方案
- 美国总统特朗普及夫人新冠病毒检测结果呈阳性 对手拜登有被飞沫感染的危险性
- 强生65亿美元收购Momenta,今年美国药业最大并购案落定
- 美国环保局质疑加州禁售燃油车计划
- 重启裁员计划,花旗美国股票交易部门至少三位高级员工被裁
- Palantir市值超200亿美元,美国科技IPO势头重启
- 无论谁赢得美国大选,特斯拉都将受益|科技心语