本报记者 张敏
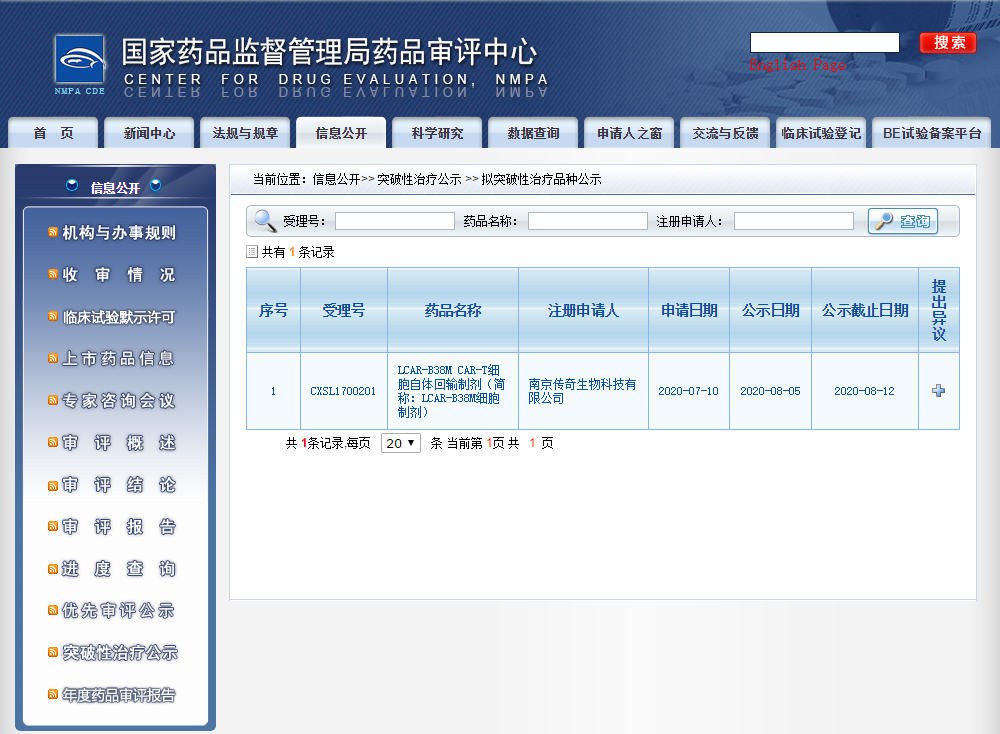
日前,中国国家药监局(NMPA)药品审评中心(CDE)最新公示,传奇生物旗下生物制品1类新药西达基奥仑赛(cilta-cel,LCAR-B38M CAR-T细胞自体回输制剂)拟纳入突破性治疗药物名单。
“突破性治疗”(breakthrough therapy designation)是中国国家药监局(NMPA)不久前发布的《突破性治疗药物审评工作程序》文件的部分内容,旨在加速开发及审查治疗严重的或威胁生命的疾病的新药。
这是NMPA发布《突破性治疗药物审评工作程序》文件后,“突破性治疗公示”专栏的首次更新,这也意味着这项特殊审评通道正式在中国启动。
根据CDE公示信息,传奇生物于今年7月10日为西达基奥仑赛申请了突破性治疗,并于8月5日拟纳入突破性治疗品种名单。纳入理由及依据为:符合《药品注册管理办法》和《国家药监局关于发布等三个文件的公告》(2020年第82号)有关要求,同意纳入突破性治疗药物程序。公示日期截至8月12日。这是CDE“突破性治疗公示”专栏首次更新。
突破性疗法药品审批有望提速
据记者了解,突破性疗法的申请适用范围为:药物临床试验期间,用于防治严重危及生命或者严重影响生存质量的疾病且尚无有效防治手段或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或者改良型新药等,申请人可以在Ⅰ、Ⅱ期临床试验阶段,通常不晚于Ⅲ期临床试验开展前申请适用突破性治疗药物程序。
对于获得“突破性疗法”认定的药品而言,将缩短其漫长而昂贵的开发过程。这让早期研究中显示出良好前景的药物尽快进入市场,而不必完成传统的3个阶段(Ⅰ~Ⅲ期临床研究)的开发计划。
此外,除了获得快速审评通道,申请者还将获得高效的审评员的指导。
西部证券此前发布的研报认为,突破性治疗药物认定规定对于重症用药和临床优势明显的药物通过突破性药物认定后将得到药审中心优先审评的资源倾斜。
在业内人士看来,中国突破性疗法将会是未来一个重要的标签,同样会代表着中国的创新水平。中国突破性疗法最重要的同样是为了进一步加速具有临床优势药物的中国上市进程;进一步满足中国重大疾病的临床治疗需求。
CAR-T细胞疗法有望加速获批
记者了解到,西达基奥仑赛是由传奇生物开发的一款靶向B细胞成熟抗原(BCMA)的CAR-T疗法,作为一种结构新颖的CAR-T细胞疗法,旨在增加其靶向癌细胞的综合能力,用于既往接受过包括蛋白酶体抑制剂,免疫调节剂和抗CD38抗体的治疗方案和在末次治疗期间或之后出现疾病进展的复发或难治性多发性骨髓瘤(RRMM)成年患者。
强生(Johnson&Johnson)旗下杨森公司(Janssen)于2017年与传奇生物达成战略合作,在全球范围内共同开发和推广该在研创新疗法。该产品于2018年获得国家药品监督管理局首个CAR-T临床试验申请(IND)批件,并与同年获得美国FDA的IND批准。在获此“突破性疗法”之前,该产品已于2019年获得欧洲药品管理局优先药物认定(PRIME)资格及美国FDA授予的突破性疗法认定。
今年6月份,传奇生物作为“中国CAR-T上市第一股”,在纳斯达克挂牌交易,是2020年截至目前生物科技公司最大规模的IPO。据传奇生物招股书显示,西达基奥仑赛将于今年底前在美国提交上市申请,并于2021年在中国提交上市申请。
此次西达基奥仑赛拟纳入突破性治疗药物名单,意味着这款产品有望加速获批,早日为患者带来新的治疗选择。
传奇生物首席执行官章方良博士表示,国家药品监督管理局药品审评中心所推荐授予的突破性治疗药物认定,对于西达基奥仑赛治疗中国的骨髓瘤患者的开发过程是一个重大的监管里程碑,传奇和杨森将合作继续致力在中国及全球推广该试验性疗法。
(编辑 乔川川)
相关推荐
猜您喜欢
- 最新数据持续向好引海外点赞中国经济复苏
- 中国改革低保等现行社会救助制度 打造多层次分类救助体系
- 疫情之下“审判执行不停摆” 中国最高法要求确保完成全年审判执行任务
- 中国创新发展目标明确 在人工智能和先进制造业等方面有规划
- 美国国务院限制中国在美外交活动 外交部回应
- 商务部:调整发布《中国禁止出口限制出口技术目录》不针对具体企业
- 中方回应美方限制中国在美外交活动:于法无据、于理不合、于情不通
- 实验室设计、人员培训……中国抗疫医疗专家组在几内亚分享这些经验
- “BesTV+”焕新上线,上海文广、东方明珠打造流媒体中国模式
- 今年中国洪涝灾害共造成7047.1万人次受灾
- 世界知识产权组织发布2020年全球创新指数 | 中国已经确立作为创新领先者地位
- 世界知识产权组织发布2020年全球创新指数 | 中国创新发展目标明确 在人工智能和先进制造业等方面有规划
- 海外参展商谈服贸会 | 阿苏港国际事务副总裁 “通往中国的高速公路”越来越宽
- 创新服贸 互惠共享 | 中国对外开放新引擎 外商共享服贸市场新机遇
- 看!那些峥嵘岁月里的“微表情”——纪念中国人民抗日战争胜利暨世界反法西斯战争胜利75周年